DNA是生命的“说明书”,但真正用于制造蛋白质的编码基因却不足2%。剩下超过98%的“非编码区域”长期被视为“基因组暗物质”。然而,这些序列虽然不直接生产蛋白质,却能决定基因何时开启、何时关闭,仿佛是藏在说明书背后,真正掌控生命节奏的“隐形操控者”。其中最重要的一类,就是被称为“增强子”的调控元件——它们就像远程遥控器,精确调节基因在不同时间、不同位置的表达强度。
12月19日,上海海洋大学水产与生命学院/水产生物育种中心胡鹏教授、陈良标教授团队在国际知名期刊《核酸研究》(Nucleic Acids Research)在线发表了题为“Systematic Enhancer Mapping and Functional Analysis in Zebrafish with Optimized CRISPR Interference” 的研究论文(https://academic.oup.com/nar/article/53/22/gkaf1367/8383833),系统报道了关于鱼类非编码调控的重要研究进展。Nucleic Acids Research在Scopus遗传学领域排名5/348,近五年年均影响因子16.8,是全球最具影响力的分子生物学期刊之一。

如果把基因比作一盏灯,传统研究往往只关注“灯泡本身”(基因编码序列),而增强子则是决定这盏灯何时亮起、亮度如何的“遥控器”。它不仅参与鱼类从单细胞向复杂个体的发育过程,也影响它们如何适应温度、盐度等环境变化,甚至决定生长速度和抗病能力等重要性状。因此,找出增强子在哪里、如何工作,就等于掌握了生命“调控密码”的关键钥匙。
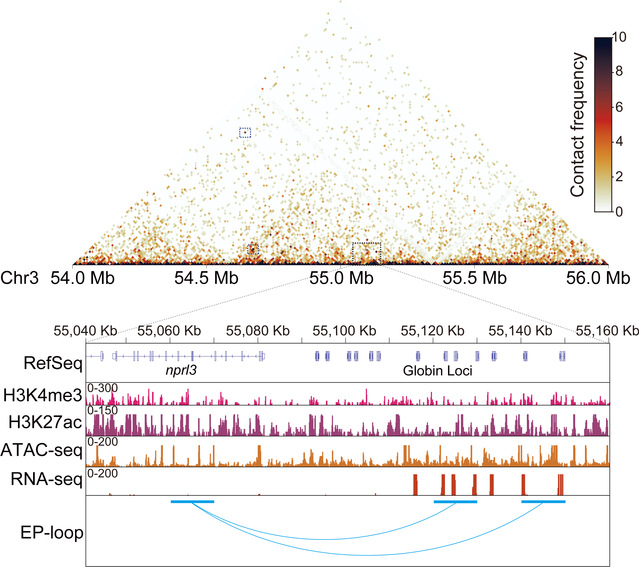
在这项工作中,团队以斑马鱼胚胎为研究对象,整合Hi-C、ATAC-seq等多组学数据,成功绘制出400多对增强子与基因之间互作关系的“基因遥控网络图”,覆盖鱼类早期发育的关键时段。在此基础上,研究人员利用CRISPRi技术按下多个增强子的“开关”,观察到了直观的生物学响应:例如,当调控血液发育的增强子被抑制后,血红蛋白水平明显下降;当控制鳍条生长的增强子被关闭时,超过40%的胚胎出现鳍条缺失表型。
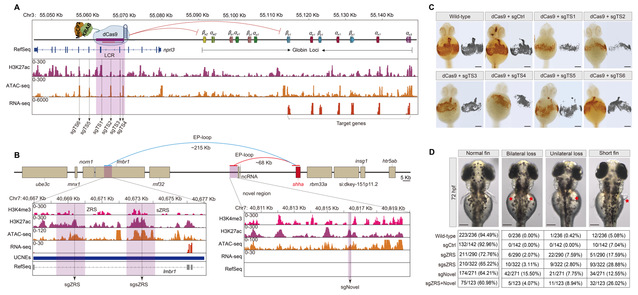
更令人兴奋的是,通过CRISPRi的精准序列匹配的sgRNA设计,研究团队不仅能够将传统预测的较大增强子区域缩小到更精确的核心位置,还成功识别出此前未被报道的全新增强子。团队将多组学信号、CRISPRi干扰后的表型以及目标基因表达量结合分析,鉴定了多个新的功能性增强子,特别是在鳍条发育方面鉴定出一个全新的关键增强子。这一技术路线具有良好的通用性,可广泛应用于寻找调控其他重要性状基因的全新增强子,为解析复杂性状背后的调控网络提供了强大的方法学框架。
随着育种技术的发展,基因组育种已能根据DNA信息预测性状,但仍主要关注编码基因。将非编码增强子纳入模型,有望带来更高的精度和更强的可控性。本研究构建的CRISPRi调控平台与增强子互作图谱,为定位决定生长、发育、抗逆等性状的关键调控“开关”提供了有效工具,也使得更加安全、更加精准的分子设计育种成为可能。未来的鱼类育种有望从“选基因”迈向“设计调控网络”的新时代。
上海海洋大学水产与生命学院水产生物育种中心胡鹏教授、陈良标教授为本文通讯作者;博士后产久林、实验师吴智超、刘明丽博士、本科生王天铭及硕士研究生刘涵宇为文章共同第一作者。上海海洋大学已毕业研究生曹瑞萌、博士研究生李新闻、硕士研究生占思瑶及已毕业本科生徐逸程在斑马鱼胚胎显微注射、组学建库实验方面做出重要贡献;实验室客座的李晓龙、程江博博士在生物信息分析方面提供了重要帮助;中国科学院水生生物研究所孙永华研究员和何牡丹副研究员在斑马鱼胚胎材料方面提供关键支持;宾夕法尼亚大学冯园庆博士、上海海洋大学许强华教授等专家在论文返修过程中提供了重要指导。本研究由国家自然科学基金、中国博士后科学基金、上海市自然科学基金及临港新片区海洋生物医药创新平台科技发展专项资金联合资助。
(供稿:水产与生命学院)